Abstract
La sindrome di Stevens-Johnson/necrolisi epidermica tossica (SJS/TEN) è uno spettro di reazioni di ipersensibilità acute e ritardate che colpiscono la pelle e le mucose. I farmaci sono la causa principale di questi disturbi, oltre alle infezioni e, in casi molto rari, alle vaccinazioni. Segnaliamo un caso di TEN in una donna di 49 anni senza storia medica precedente. Il disturbo si è sviluppato una settimana dopo aver ricevuto la prima dose di vaccino COVID-19 senza altre cause identificabili. La paziente ha ricevuto due dosi di inibitore del fattore di necrosi tumorale alfa (etanercept) e ha smesso di sviluppare nuove lesioni dopo due giorni dalla dose iniziale; la guarigione completa è stata osservata dopo 22 giorni e nessun effetto collaterale è stato osservato nel nostro paziente. Questo caso dimostra una complicazione estremamente rara al vaccino COVID-19. I benefici di ricevere il COVID-19 superano il rischio potenziale.
Introduzione
La necrolisi epidermica tossica (TEN) è una rara reazione cutanea immunomediata, pericolosa per la vita, caratterizzata da vesciche ed esteso distacco epidermico di più di 30% di superficie corporea. L'incidenza è stimata da 0,4 a 1,9 casi per milione di popolazione all'anno in tutto il mondo e un tasso di mortalità stimato da 25% a 35% [1, 2]. I farmaci sono di solito la causa della TEN (ad esempio, alcuni antibiotici e antiepilettici). [3]. La sindrome di Stevens-Johnson indotta da vaccinazione (SJS)/TEN è rara, con meno di venti casi riportati nella letteratura pubblicata, con il vaccino contro il morbillo che è stato segnalato per causare sia SJS che TEN, la varicella, il vaiolo, il carbonchio, il tetano e i vaccini contro l'influenza sono stati segnalati per causare solo SJS, e i vaccini MMR (morbillo, parotite, rosolia), hantavirus e meningococco B sono stati riportati per causare TEN [4, 5, 6]. Il paziente di solito sviluppa una febbre e altri sintomi simil-influenzali da una a tre settimane dopo essere stato esposto al farmaco, seguiti da dolorose lesioni cutanee da eritematose a purpuriche che tendono a coalizzarsi. Successivamente si sviluppano erosioni e lesioni vescicolose e distacco epidermico su un'ampia superficie corporea. Anche le membrane mucose sono coinvolte e il paziente sviluppa ulcere orali, vaginali e una possibile congiuntivite acuta. [7]. In questo articolo, riportiamo un caso di TEN in seguito alla somministrazione del vaccino Pfizer COVID-19 (Pfizer, Inc., New York, USA).
Presentazione del caso
Una donna di 49 anni senza storia medica precedente si è presentata al pronto soccorso con una storia di febbre ed eruzione cutanea. Ha ricevuto il vaccino COVID-19 Pfizer (BNT162b1) con una dose di 0,3 mL data per via intramuscolare una settimana prima dello sviluppo dei suoi sintomi. La paziente ha iniziato a sviluppare febbre, affaticamento e mal di testa seguiti da lesioni cutanee che interessavano il tronco e iniziavano a diffondersi al viso e agli arti superiori con ulcerazione orale. Il paziente è stato visto nel centro di assistenza sanitaria primaria e gli è stato dato del paracetamolo e non ha notato alcun miglioramento. Il paziente non aveva alcuna storia di assunzione di nuovi farmaci o di qualsiasi trattamento cosmetico negli ultimi due mesi prima dello sviluppo delle lesioni cutanee. All'esame, il paziente era vitalmente stabile, ansioso e con forti dolori. Aveva numerose macule purpuree e rosso scuro che coinvolgevano il petto (Figura 1), addome (Figura 2), arti superiori (Figura 3), il viso, i genitali e la parte superiore delle cosce con aree che mostrano la coalescenza delle lesioni con bolle flaccide e aree di distacco epidermico con segno di Nikolsky positivo. La mucosa era coinvolta nelle sue condizioni, dove aveva un'estesa ulcerazione orale e croste emorragiche sulle labbra (Figura 4), così come le congestioni congiuntivali bilaterali insieme alle erosioni delle palpebre superiori (Figura 5) e lesioni della mucosa genitale. Il suo coinvolgimento della superficie corporea (BSA) è stimato in più di 30%. La valutazione di laboratorio ha mostrato bassi WBC (3,87 × 109/L) ed elevati enzimi epatici (aspartato aminotransferasi [AST] 178 U/L, alanina aminotransferasi [ALT] 90 U/L). La radiografia del torace era normale, e lei aveva una sierologia negativa per l'epatite B, C e HIV. Il punteggio Severity-of-Illness Score for Toxic Epidermal Necrolysis (SCORTEN) era due il giorno del suo ricovero poiché aveva più di 40 anni e un livello di bicarbonato sierico inferiore a <20 mmol/L.
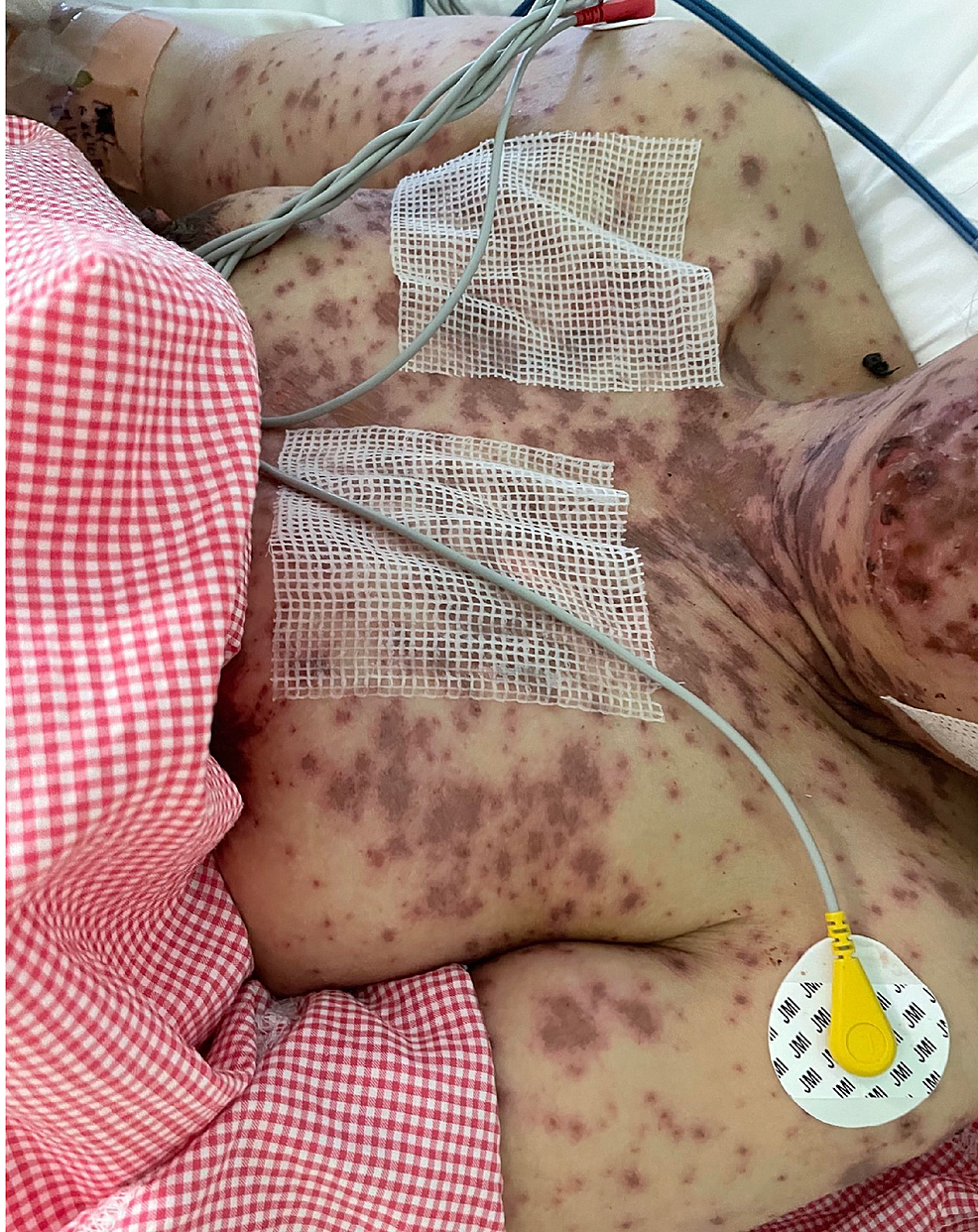
Figura 1: Immagine complessiva del torace prima di iniziare il trattamento
L'immagine mostra chiazze multiple purpuriche con distacco epidermico che interessano il petto.
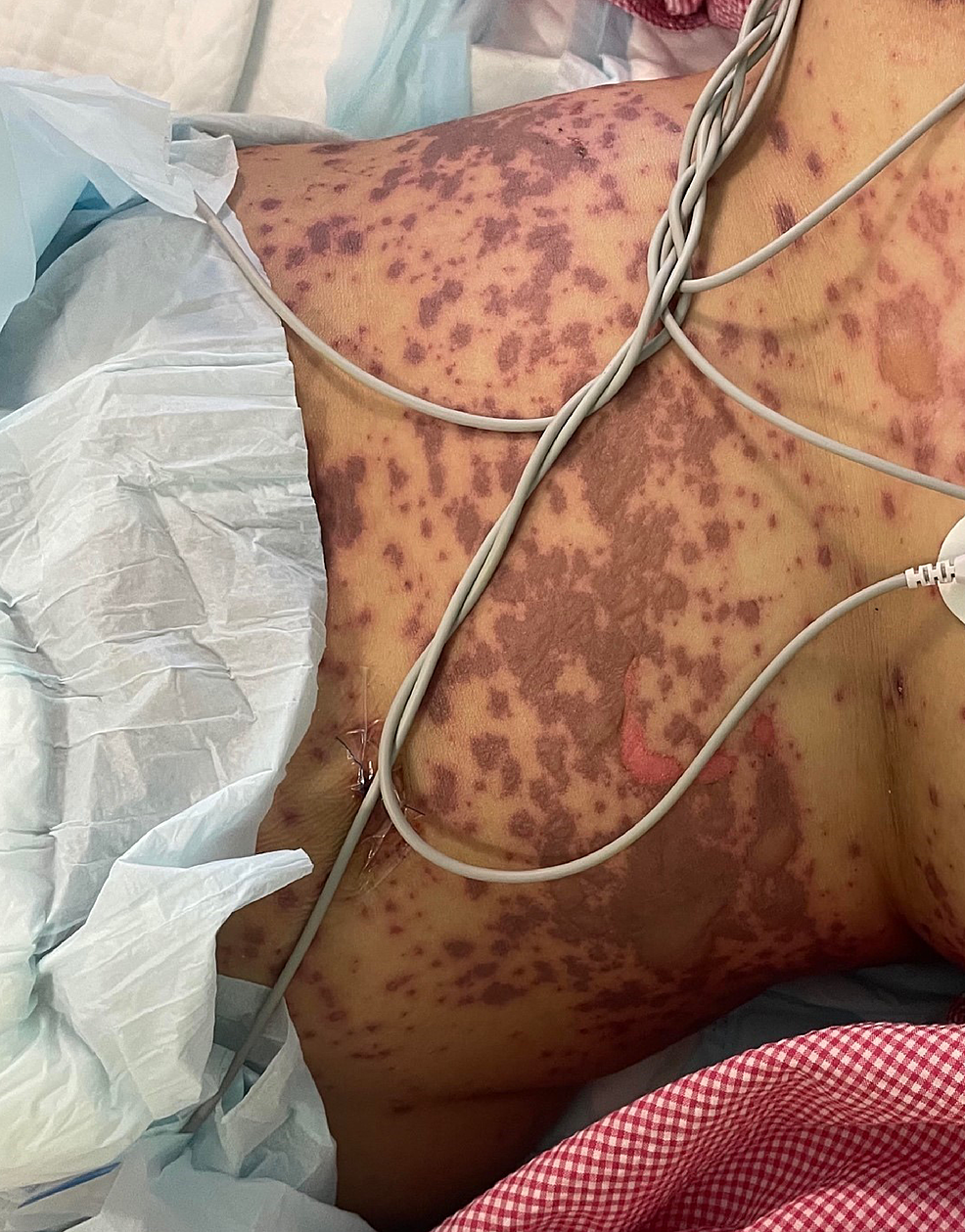
Figura 2: Immagine complessiva dell'addome prima di iniziare il trattamento
L'immagine mostra macchie multiple purpuriche con distacco epidermico che interessano l'addome.
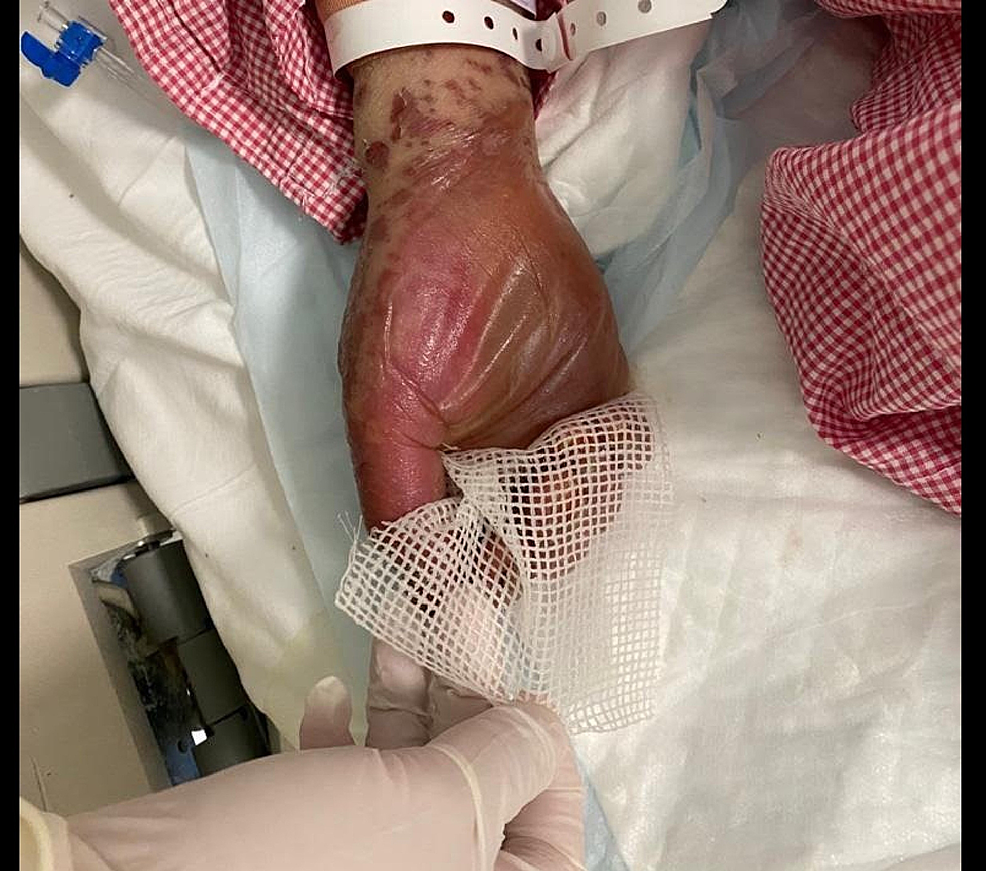
Figura 3: Immagine complessiva della mano prima di iniziare il trattamento
L'immagine mostra bolle e distacco epidermico che interessano i palmi delle mani.
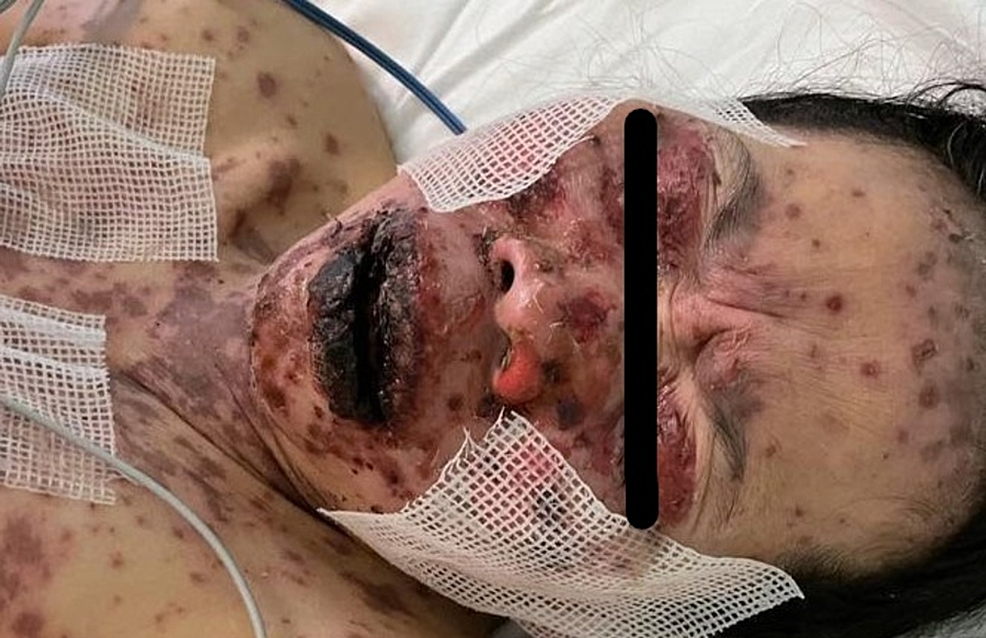
Figura 4: Immagine complessiva del viso prima di iniziare il trattamento
L'immagine mostra una grave crosta emorragica delle labbra.
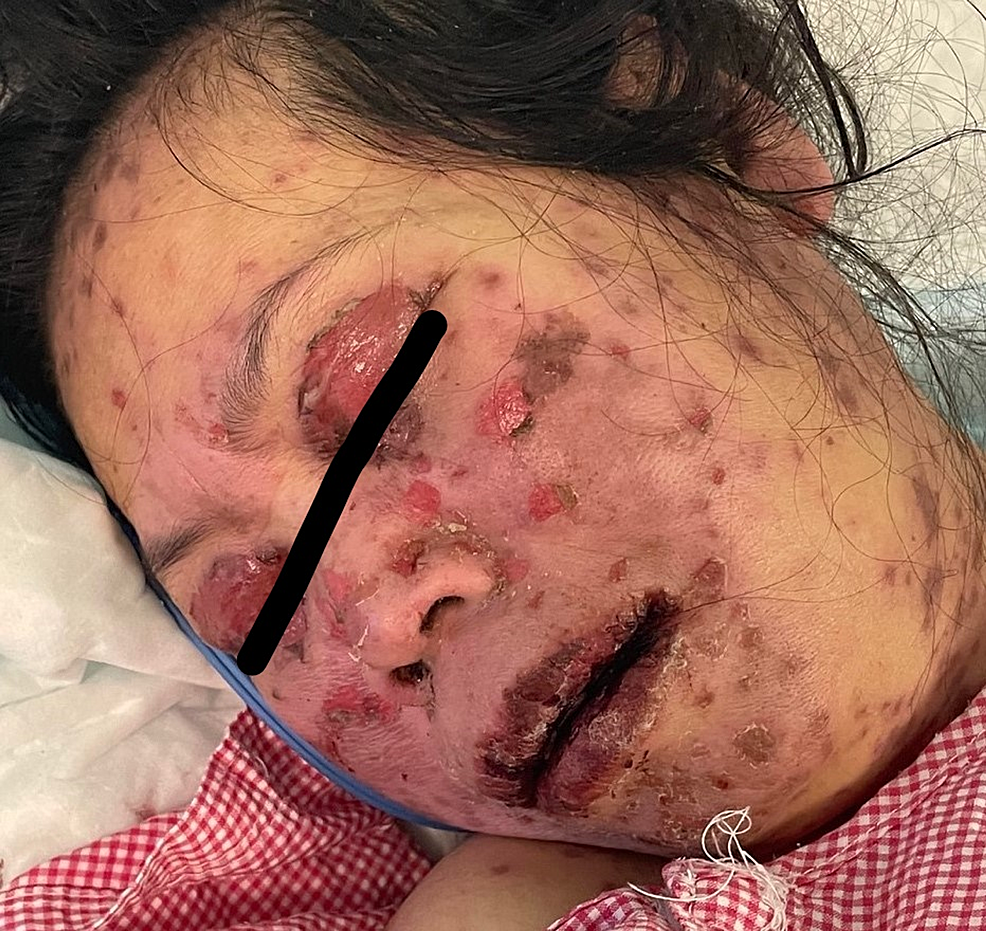
Figura 5: Immagine complessiva del viso prima di iniziare il trattamento
L'immagine mostra erosioni multiple che interessano il viso e le palpebre superiori.
L'esame istopatologico della lesione ha mostrato una necrosi epidermica a tutto spessore con separazione dermo-epidermica e cheratinociti necrotici (Figura 6).
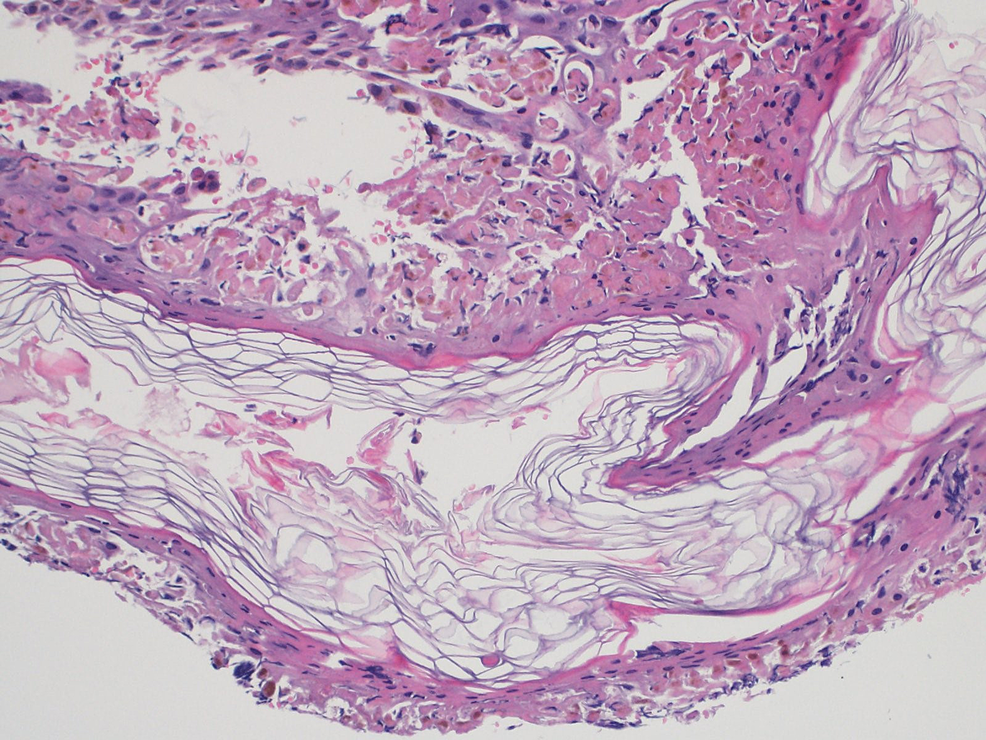
Figura 6: biopsia prima di iniziare il trattamento
La biopsia ha mostrato una necrosi epidermica a tutto spessore con separazione dermo-epidermica e cheratinociti necrotici.
Il paziente è stato ricoverato nell'unità ad alta dipendenza (HDU) e trattato in modo asettico; sono stati avviati la sostituzione dei fluidi per via endovenosa e il supporto nutrizionale. I team di oftalmologia, ginecologia e urologia sono stati coinvolti nella gestione del caso poiché la sua malattia coinvolgeva gli occhi e aveva bisogno di antibiotici e lubrificanti topici. Inoltre, aveva delle erosioni che coinvolgevano i suoi genitali, quindi, è stata applicata una garza di vaselina topica e i team di OB/GYN e urologia l'hanno seguita per prevenire complicazioni future. Alla paziente sono state somministrate due dosi di etanercept 50 mg/ml per via sottocutanea, la prima il giorno dell'ammissione e la seconda dopo due giorni dall'ammissione. Il paziente ha smesso di sviluppare nuove lesioni dopo due giorni dalla prima dose, e la guarigione completa è stata notata dopo 22 giorni (Figure 7, 8). Nessun effetto collaterale è stato notato nel nostro paziente.
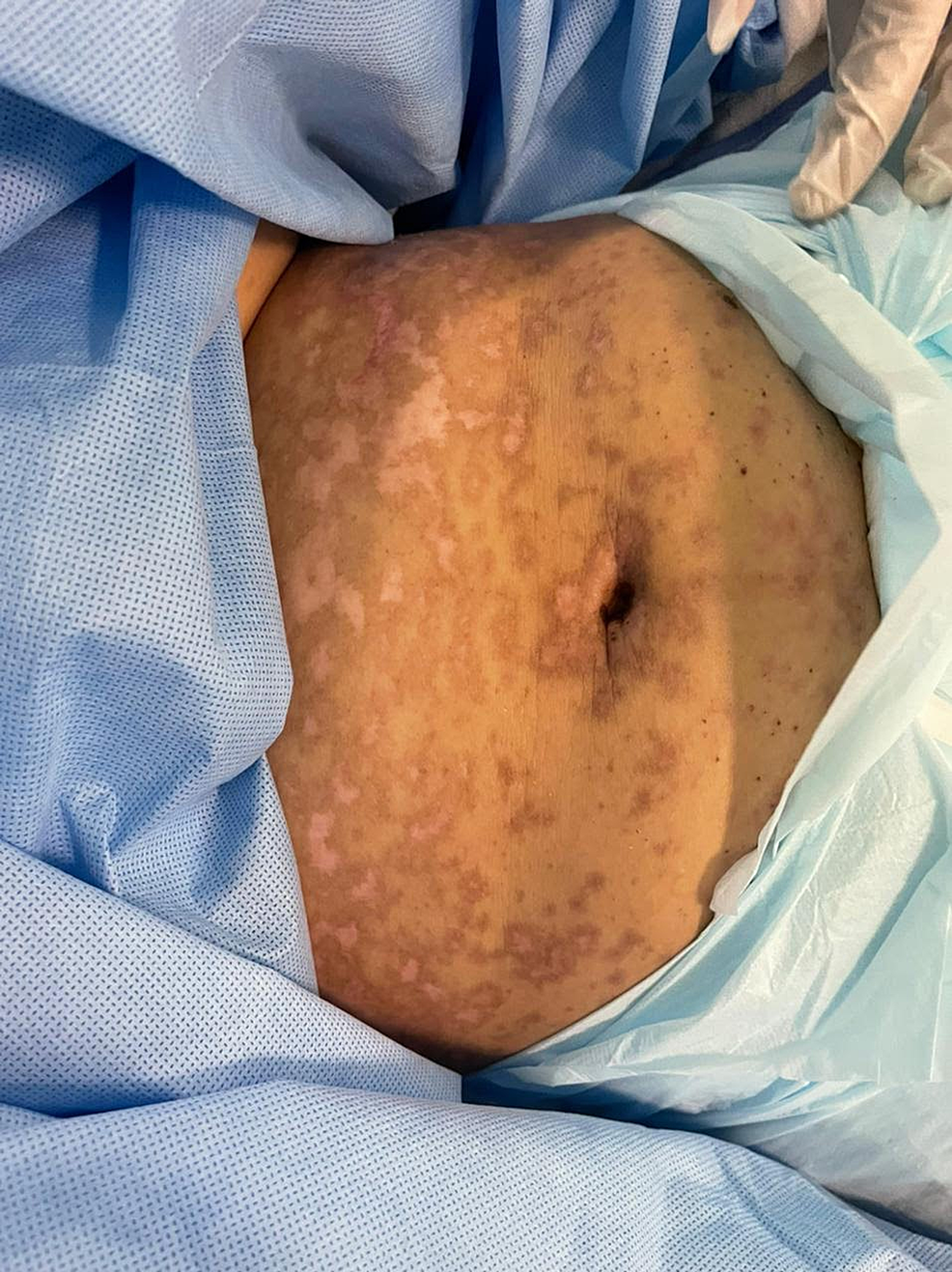
Figura 7: immagine complessiva dell'addome dopo la terapia
L'immagine mostra aree di iper-ipopigmentazione che coinvolgono l'addome e il petto.
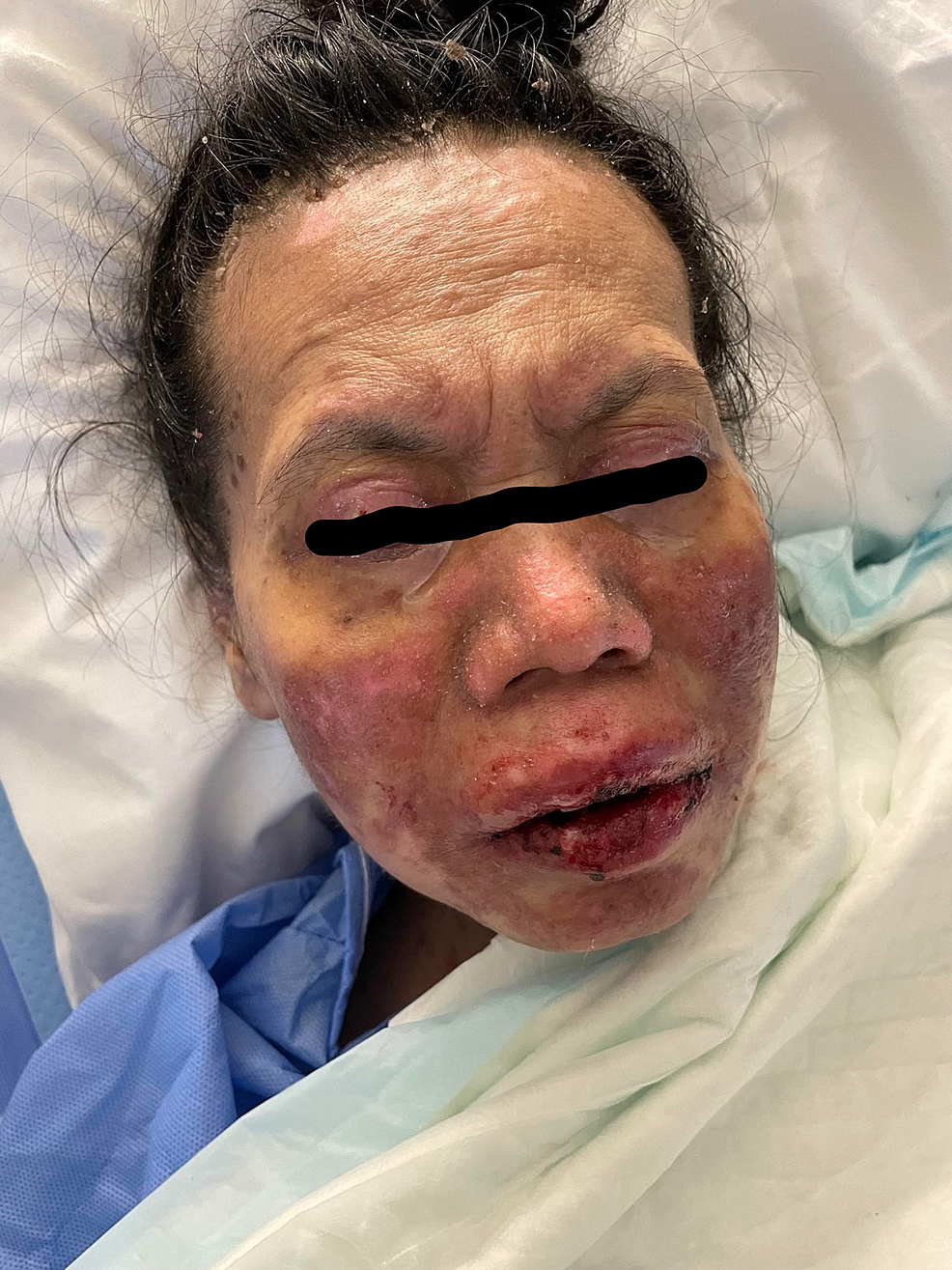
Figura 8: Immagine complessiva del viso dopo la terapia
L'immagine mostra aree di iper-ipopigmentazione che interessano il viso.
Discussione
SJS/TEN rappresenta un gruppo di rare, gravi e potenzialmente fatali reazioni di quattro ipersensibilità ritardate. Le droghe sono di gran lunga la causa più comune di queste condizioni. Tuttavia, la SJS/TEN potrebbe essere in casi molto rari causata dalla vaccinazione. [5]. La presentazione inizia con sintomi simili all'influenza, seguiti da un'eruzione cutanea dolorosa che si diffonde e si riempie di vesciche. Le lesioni TEN consistono in lesioni targetoidi e macule purpuriche con necrosi epidermica a tutto spessore, insieme al coinvolgimento della membrana mucosa. La TEN è considerata un'emergenza medica che richiede un intervento medico urgente, per cui l'agente offensivo, se presente, deve essere interrotto immediatamente. I siti più coinvolti nella SJS/TEN sono il viso, i palmi delle mani, le suole e l'area presternale del torso. Inoltre, la mucosa genitale, oculare e buccale sono comunemente coinvolte. [8]. Nella SJS, meno di 10% della superficie corporea è coinvolta, mentre nella TEN, più di 30% della superficie corporea è coinvolta. Se il coinvolgimento cutaneo è compreso tra 10% e 30%, viene considerato come sovrapposizione SJS-TEN. Si ritiene che la fisiopatologia dietro lo sviluppo di SJS/TEN sia dovuta ai linfociti CD8+ specifici per il farmaco, dove queste cellule T citotossiche rilasciano granulisina, granzima B e perforina - questi enzimi portano alla formazione di pori e all'attivazione della cascata di morte nelle cellule colpite. Inoltre, il fattore di necrosi tumorale (TNF)-alfa e l'interferone-gamma sono secreti in quantità significative dalle cellule T attivate, portando alla sovraespressione dei ligandi Fas e alla morte dei cheratinociti mediata da Fas. [9] (Figura 9).
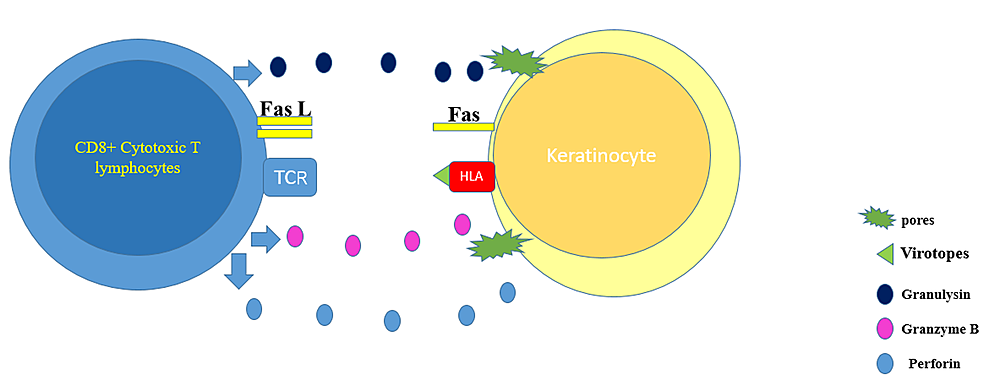
Figura 9: Il grafico rappresenta la patogenesi dietro l'antigene virotopes nel vaccino COVID-19
Il grafico mostra come l'antigene virotopes nel vaccino COVID-19 può indurre la morte dei cheratinociti attraverso l'attivazione dei linfociti T.
TCR: recettore delle cellule T; HLA: antigene leucocitario umano.
Il grafico è stato creato dal Dr. Bakir usando PowerPoint (Microsoft Corporation, Redmond, USA).
Il vaccino COVID-19 è fatto di due componenti (eccipienti e virotopi). È stato ipotizzato che l'antigene virotopes, che è espresso sulla superficie dei cheratinociti, potrebbe portare all'attivazione dei linfociti T citotossici e alla morte delle cellule epidermiche. [10, 11]. SJS/TEN è una diagnosi clinica e istopatologica. All'istopatologia, c'è necrosi dei cheratinociti e infiltrato linfocitario dermico con test immunofluorescente negativo. I pazienti con TEN richiedono cure di supporto come l'interruzione dell'agente o degli agenti offensivi, il ricovero in terapia intensiva o in un'unità ustionati, la sostituzione di fluidi ed elettroliti, l'alimentazione con tubo nasogastrico o la nutrizione parenterale totale insieme al controllo del dolore e della temperatura. La sepsi e l'insufficienza d'organo sono la complicazione più temuta della TEN. I livelli di TNF-alfa hanno dimostrato di essere elevati nei campioni di biopsia della pelle, nel liquido delle vesciche e nel siero dei pazienti TEN, incoraggiando l'uso della terapia biologica che utilizza l'azione anti-TNF-alfa. [12, 13]. In uno degli studi, una singola dose di etanercept (Enbrel, Immunex Corporation, Seattle, USA) 50 mg/mL per via sottocutanea sembrava modificare il corso della malattia dove una significativa riduzione dell'edema e l'arresto dello sviluppo della malattia è stato notato in sole 24 ore. [14]. Negli ultimi anni, sono stati utilizzati antagonisti del TNF-alfa e la maggior parte dei casi ha mostrato un miglioramento significativo con la formazione di lesioni che cessano entro due giorni e la risoluzione completa entro 20 giorni. Inoltre, nei pazienti SJS/TEN trattati con etanercept, non sono stati documentati effetti collaterali gravi. Inoltre, rispetto agli individui a cui sono stati somministrati corticosteroidi, c'era un tasso inferiore di emorragia gastrointestinale e una diminuzione dei livelli di espressione di granulysin e TNF-alfa. [15]. La plasmaferesi, l'immunoglobulina intravenosa (IVIG), e forse più promettentemente gli inibitori del TNF come l'etanercept sono tutte possibilità di trattamento per la TEN indotta dal vaccino [14]. Tuttavia, l'uso di IVIG e corticosteroidi sistemici ad alte dosi è ancora controverso. [16]. Si ritiene che la plasmaferesi funzioni nei pazienti TEN sulla base della premessa di rimuovere il farmaco, il metabolita del farmaco o il mediatore citotossico dalla circolazione. Tuttavia, uno studio svedese non ha trovato alcun beneficio con la plasmaferesi in otto pazienti rispetto ai pazienti di altri studi che hanno ricevuto cure di supporto equivalenti ma non la plasmaferesi. [17]. In questa fase, non ci sono dati sufficienti per giustificare l'uso della plasmaferesi rispetto ad altri metodi aggiuntivi. [18]. In uno studio controllato randomizzato che ha confrontato l'efficacia dell'etanercept e dei corticosteroidi in pazienti SJS/TEN, l'etanercept è stato trovato per promuovere la guarigione della pelle e della mucosa orale e facilitare la riepitelizzazione. [15]. A nostra conoscenza, questo è il primo caso riportato di TEN secondaria al vaccino COVID-19 di Pfizer. Ci sono stati due casi di SJS post vaccino COVID-19, nel primo caso, non hanno menzionato il nome o la dose del vaccino che il loro paziente aveva ricevuto. [11]. Tuttavia, nel secondo caso, hanno menzionato che il loro paziente ha sviluppato SJS dopo aver ricevuto la seconda dose del vaccino Pfizer COVID-19. [19]. Il nostro paziente ha avuto un recupero completo dopo aver ricevuto due dosi di etanercept.
Conclusioni
Questo caso evidenzia una conseguenza estremamente rara del vaccino. Ma i benefici superano di gran lunga i rischi nelle circostanze attuali, quindi non ci dovrebbe essere alcuna esitazione nella comunità a chiedere la vaccinazione. Pertanto, come riportiamo questo caso, sottolineiamo la rarità del verificarsi di questo effetto collaterale, e date le circostanze, questo non dovrebbe influenzare la decisione di prendere il vaccino, né aggiungere alle idee sbagliate là fuori. Nel nostro caso, abbiamo spiegato la fisiopatologia dietro lo sviluppo della necrolisi epidermica tossica secondaria alla vaccinazione e abbiamo evidenziato il successo di eternacept come trattamento sicuro e veloce di questa condizione.
Riferimenti
- Schwartz RA, McDonough PH, Lee BW: Necrolisi epidermica tossica: Parte I. Introduzione, storia, classificazione, caratteristiche cliniche, manifestazioni sistemiche, eziologia e immunopatogenesi. J Am Acad Dermatol. 2013, 69:173.e1-13; quiz 185-6. 10.1016/j.jaad.2013.05.003
- Schwartz RA, McDonough PH, Lee BW: Necrolisi epidermica tossica: parte II. Prognosi, sequele, diagnosi, diagnosi differenziale, prevenzione e trattamento. J Am Acad Dermatol. 2013, 69:187.e1-16; quiz 203-4. 10.1016/j.jaad.2013.05.002
- Mockenhaupt M: Epidemiologia delle reazioni avverse cutanee ai farmaci. Chem Immunol Allergy. 2012, 97:1-17. 10.1159/000335612
- Rosenblatt AE, Stein SL: Reazioni cutanee alle vaccinazioni. Clin Dermatol. 2015, 33:327-32. 10.1016/j.clindermatol.2014.12.009
- Ball R, Ball LK, Wise RP, Braun MM, Beeler JA, Salive ME: Sindrome di Stevens-Johnson e necrolisi epidermica tossica dopo la vaccinazione: rapporti al sistema di segnalazione degli eventi avversi del vaccino. Pediatr Infect Dis J. 2001, 20:219-23. 10.1097/00006454-200102000-00022
- Dobrosavljevic D, Milinkovic MV, Nikolic MM: Necrolisi epidermica tossica dopo la vaccinazione morbilli-parotite-rubella. J Eur Acad Dermatol Venereol. 1999, 13:59-61.
- Harr T, French LE: Sindrome di Stevens-Johnson e necrolisi epidermica tossica. Chem Immunol Allergy. 2012, 97:149-66. 10.1159/000335627
- Grazina I, Mannocci A, Meggiolaro A, La Torre G: Esiste un'associazione tra la sindrome di Stevens-Johnson e la vaccinazione? Una revisione sistematica. Ann Ig. 2020, 32:81-96. 10.7416/ai.2020.2333
- Oakley AM, Krishnamurthy K: Sindrome di Stevens Johnson. StatPearls [Internet]. StatPearls Publishing (ed): Treasure Island, 2021; 2021 gen-.
- Stone CA Jr, Rukasin CR, Beachkofsky TM, Phillips EJ: Reazioni avverse immunomediate ai vaccini. Br J Clin Pharmacol. 2019, 85:2694-706. 10.1111/bcp.14112
- Dash S, Sirka CS, Mishra S, Viswan P: Sindrome di Steven-Johnson indotta dal vaccino Covid-19: un rapporto di caso. Clin Exp Dermatol. 2021, 10.1111/ced.14784
- Paquet P, Paquet F, Al Saleh W, Reper P, Vanderkelen A, Piérard GE: Cellule effettrici immunoregolatrici nella necrolisi epidermica tossica indotta da farmaci. Am J Dermatopathol. 2000, 22:413-7. 10.1097/00000372-200010000-00005
- Posadas SJ, Padial A, Torres MJ, et al: Le reazioni ritardate ai farmaci mostrano che i livelli di perforina, granzima B e Fas-L sono correlati alla gravità della malattia. J Allergy Clin Immunol. 2002, 109:155-61. 10.1067/mai.2002.120563
- Chahal D, Aleshin M, Turegano M, Chiu M, Worswick S: Necrolisi epidermica tossica indotta da vaccino: un caso e una revisione sistematica. Dermatol Online J. 2018241, 13030-7. 10.5070/D3241037941
- Wang CW, Yang LY, Chen CB, et al: Studio randomizzato e controllato dell'antagonista del TNF-α nelle reazioni avverse cutanee gravi mediate dal CTL. J Clin Invest. 2018, 128:985-96. 10.1172/JCI93349
- St John J, Ratushny V, Liu KJ, et al: Uso riuscito della ciclosporina a per la sindrome di Stevens-Johnson e la necrolisi epidermica tossica in tre bambini. Pediatr Dermatol. 2017, 34:540-6. 10.1111/pde.13236
- Furubacke A, Berlin G, Anderson C, Sjöberg F: Mancanza di un effetto significativo dello scambio di plasma nel trattamento della necrolisi epidermica tossica indotta da farmaci?. Intensive Care Med. 1999, 25:1307-10. 10.1007/s001340051063
- Fernando SL: La gestione della necrolisi epidermica tossica. Australas J Dermatol. 2012, 53:165-71. 10.1111/j.1440-0960.2011.00862.x
- Elboraey MO, Essa EE: Sindrome di Stevens-Johnson dopo la seconda dose di vaccino Pfizer COVID-19: un rapporto di caso. Oral Surg Oral Med Oral Pathol Oral Radiol. 2021, 10.1016/j.oooo.2021.06.019
Articolo originale: http://cureus.com/articles/68051-toxic-epidermal-necrolysis-post-covid-19-vaccination—first-reported-case
